Descubre los coeficientes estequiométricos en ecuaciones químicas
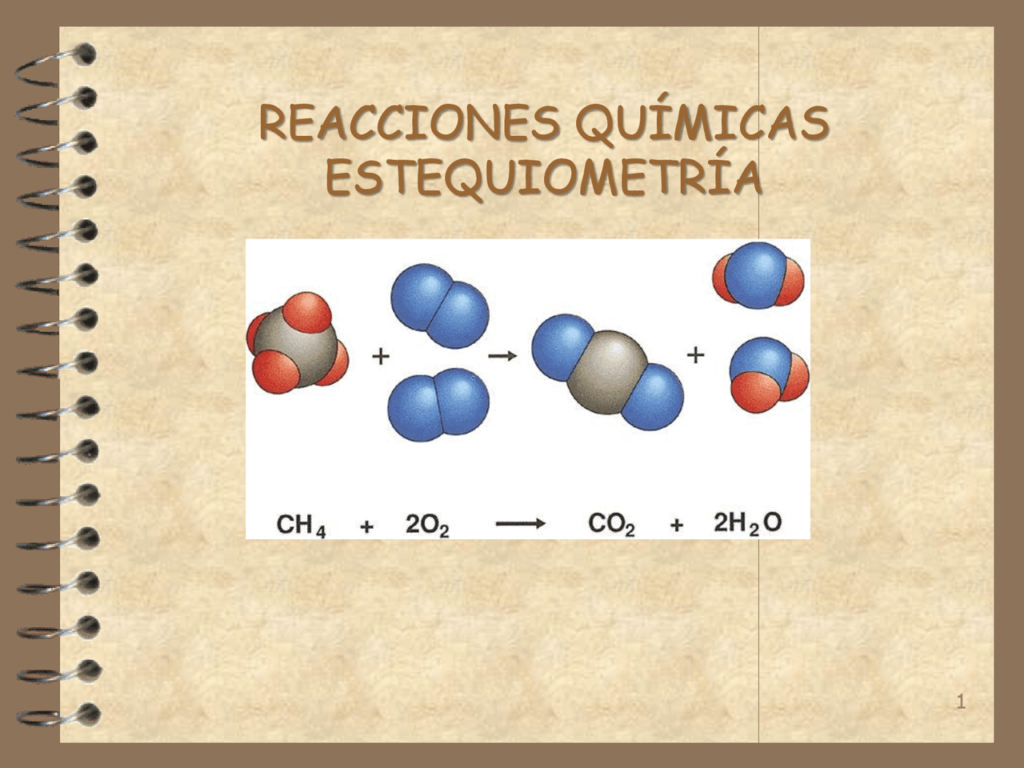
La estequiometría es una parte fundamental de la química, que se encarga de estudiar las relaciones cuantitativas entre las sustancias que intervienen en una reacción química. En este sentido, una ecuación química es una representación simbólica de una reacción química, donde se muestran las sustancias que reaccionan y las sustancias que se forman. En cada ecuación química, se pueden observar unos números que aparecen delante de cada sustancia, que se conocen como coeficientes estequiométricos. En este artículo, descubrirás todo lo que necesitas saber sobre los coeficientes estequiométricos en las ecuaciones químicas.
- ¿Qué son los coeficientes estequiométricos?
- ¿Por qué son importantes los coeficientes estequiométricos?
- ¿Cómo se determinan los coeficientes estequiométricos?
- ¿Qué pasa si no se balancea correctamente una ecuación química?
- ¿Cómo se utilizan los coeficientes estequiométricos para calcular las cantidades de reactivos y productos?
- Conclusión
¿Qué son los coeficientes estequiométricos?
Los coeficientes estequiométricos son los números que aparecen delante de cada sustancia en una ecuación química balanceada. Estos números indican la cantidad relativa de cada sustancia que interviene en la reacción química. Es importante tener en cuenta que los coeficientes estequiométricos son números enteros, y se utilizan para que la ecuación química esté correctamente balanceada.
Por ejemplo, la ecuación química para la reacción entre el hidrógeno y el oxígeno para formar agua es:
2H2 + O2 → 2H2O
En esta ecuación, el coeficiente estequiométrico del hidrógeno es 2, el coeficiente estequiométrico del oxígeno es 1 y el coeficiente estequiométrico del agua es 2. Esto significa que se necesitan dos moléculas de hidrógeno y una molécula de oxígeno para formar dos moléculas de agua.
¿Por qué son importantes los coeficientes estequiométricos?
Los coeficientes estequiométricos son importantes por varias razones. En primer lugar, permiten balancear correctamente una ecuación química. Una ecuación química balanceada es aquella en la que el número de átomos de cada elemento que aparece en los reactivos es igual al número de átomos de cada elemento que aparece en los productos. Esto es importante porque en una reacción química no se pueden crear ni destruir átomos, sino que simplemente se reorganizan para formar nuevas sustancias.
En segundo lugar, los coeficientes estequiométricos permiten calcular las cantidades relativas de reactivos y productos que se necesitan o se obtienen en una reacción química. Por ejemplo, si se sabe que se necesitan 2 moléculas de hidrógeno y 1 molécula de oxígeno para formar 2 moléculas de agua, se puede calcular cuántas moléculas de agua se pueden obtener a partir de una cantidad determinada de hidrógeno y oxígeno.
¿Cómo se determinan los coeficientes estequiométricos?
Los coeficientes estequiométricos se determinan a partir de la ley de conservación de la masa, que establece que en una reacción química la masa total de los reactivos es igual a la masa total de los productos. Para balancear una ecuación química, se sigue el siguiente procedimiento:
1. Escribir la ecuación química sin coeficientes estequiométricos.
2. Identificar los átomos de cada elemento que aparecen en los reactivos y en los productos.
3. Balancear primero los átomos de los elementos que aparecen en una sola molécula en cada lado de la ecuación.
4. Balancear los átomos de los elementos que aparecen en más de una molécula en cada lado de la ecuación.
5. Verificar que el número de átomos de cada elemento sea el mismo en los reactivos y en los productos.
6. Añadir los coeficientes estequiométricos necesarios para que la ecuación química esté balanceada.
¿Qué pasa si no se balancea correctamente una ecuación química?
Si no se balancea correctamente una ecuación química, se pueden obtener resultados erróneos al calcular las cantidades de reactivos y productos que se necesitan o se obtienen en una reacción química. También es posible que la reacción no se produzca de manera eficiente o que se produzcan sustancias no deseadas.
Por ejemplo, si en la reacción entre el hidrógeno y el oxígeno para formar agua se utiliza la siguiente ecuación química:
H2 + O2 → H2O
Esta ecuación no está balanceada, ya que hay dos átomos de hidrógeno en los reactivos y sólo uno en los productos. Si se utiliza esta ecuación para calcular la cantidad de agua que se puede obtener a partir de una cantidad determinada de hidrógeno y oxígeno, se obtendrá un resultado erróneo.
¿Cómo se utilizan los coeficientes estequiométricos para calcular las cantidades de reactivos y productos?
Los coeficientes estequiométricos se utilizan para calcular las cantidades de reactivos y productos utilizando la ley de conservación de la masa. Para ello, se sigue el siguiente procedimiento:
1. Escribir la ecuación química balanceada.
2. Convertir las cantidades de los reactivos o productos a moles.
3. Utilizar los coeficientes estequiométricos para determinar la proporción en la que reaccionan los reactivos y se forman los productos.
4. Convertir las cantidades de los productos a unidades de medida deseadas.
Por ejemplo, si se quiere saber cuántos gramos de agua se pueden obtener a partir de 3 moles de hidrógeno y 1,5 moles de oxígeno, se puede utilizar la siguiente ecuación química balanceada:
2H2 + O2 → 2H2O
Para calcular la cantidad de agua que se puede obtener, se sigue el siguiente procedimiento:
1. Se convierten los moles de hidrógeno a moles de agua utilizando el coeficiente estequiométrico correspondiente:
3 moles H2 x (2 moles H2O / 2 moles H2) = 3 moles H2O
2. Se convierten los moles de oxígeno a moles de agua utilizando el coeficiente estequiométrico correspondiente:
1,5 moles O2 x (2 moles H2O / 1 mol O2) = 3 moles H2O
3. Se suman los moles de agua obtenidos a partir de cada reactivo:
3 moles H2O + 3 moles H2O = 6 moles H2O
4. Se convierten los moles de agua a gramos de agua utilizando la masa molar del agua:
6 moles H2O x (18,02 g / mol) = 108,12 g H2O
Por lo tanto, a partir de 3 moles de hidrógeno y 1,5 moles de oxígeno, se pueden obtener 108,12 gramos de agua.
Conclusión
Los coeficientes estequiom
Deja una respuesta