Descubre la electronegatividad: medida del poder de atracción
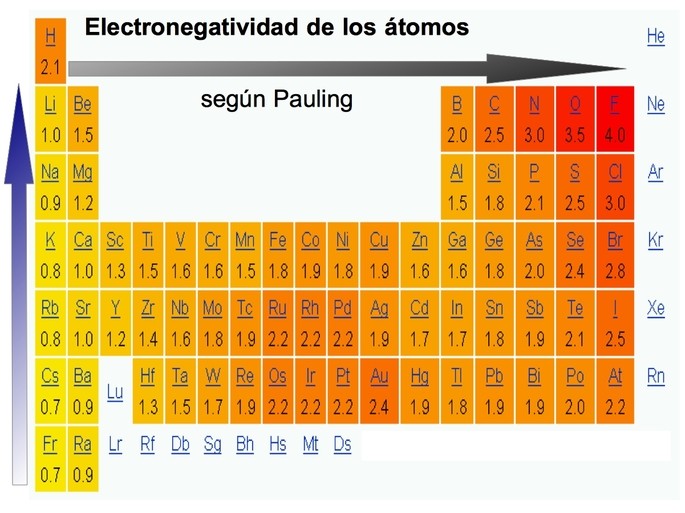
La electronegatividad es una propiedad química que mide la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma un enlace químico con otro átomo. Es decir, es la medida del poder de atracción que tiene un átomo sobre los electrones compartidos en un enlace químico.
Para entender mejor la electronegatividad, podemos compararla con un imán. Al igual que un imán atrae objetos metálicos hacia sí mismo, un átomo con alta electronegatividad atrae electrones hacia su núcleo. Por otro lado, un átomo con baja electronegatividad no tiene la misma capacidad de atracción sobre los electrones.
La electronegatividad se mide en una escala llamada escala de Pauling, nombrada en honor al químico Linus Pauling. En esta escala, el flúor tiene el valor más alto de electronegatividad, con una puntuación de 4.0, mientras que los elementos con la electronegatividad más baja son los metales alcalinos, como el cesio y el francio.
La electronegatividad es un factor importante a considerar cuando se estudian enlaces químicos. En un enlace covalente, donde dos átomos comparten electrones, el átomo con mayor electronegatividad atrae más fuertemente a los electrones compartidos. Esto puede crear una distribución desigual de carga en la molécula, lo que se conoce como polaridad.
La polaridad de una molécula puede afectar su comportamiento químico y físico. Por ejemplo, las moléculas polares tienden a ser solubles en agua, mientras que las moléculas no polares no lo son. Además, la polaridad puede afectar la reactividad química de una molécula.
La electronegatividad también es importante en la formación de enlaces iónicos, donde los átomos transfieren electrones para formar iones con carga opuesta. En este caso, el átomo con mayor electronegatividad atrae más fuertemente al electrón transferido, lo que resulta en la formación de un ion negativo (anión) y un ion positivo (catión).
La electronegatividad es una medida del poder de atracción que tiene un átomo sobre los electrones compartidos en un enlace químico. Es un factor importante a considerar en la formación de enlaces covalentes y enlaces iónicos, y puede afectar la polaridad y la reactividad química de las moléculas.
Factores que afectan la electronegatividad
La electronegatividad de un átomo puede verse afectada por varios factores, incluyendo su tamaño, su carga nuclear efectiva y su distancia a los electrones de valencia.
Tamaño del átomo
En general, cuanto más pequeño es un átomo, mayor es su electronegatividad. Esto se debe a que los electrones de valencia están más cerca del núcleo, lo que resulta en una mayor atracción entre el núcleo y los electrones.
Carga nuclear efectiva
La carga nuclear efectiva se refiere a la carga positiva neta que siente un electrón en un átomo. Cuanto mayor sea la carga nuclear efectiva, mayor será la electronegatividad del átomo. Esto se debe a que la carga positiva del núcleo atrae a los electrones más fuertemente.
Distancia a los electrones de valencia
La electronegatividad también puede verse afectada por la distancia entre el núcleo y los electrones de valencia. Cuanto más cerca estén los electrones de valencia del núcleo, mayor será la electronegatividad del átomo.
Tabla de electronegatividades
A continuación, se muestra una tabla con las electronegatividades de los elementos más comunes en la escala de Pauling.
| Elemento | Electronegatividad |
|---|---|
| Hidrógeno | 2.20 |
| Carbono | 2.55 |
| Nitrógeno | 3.04 |
| Oxígeno | 3.44 |
| Flúor | 4.00 |
| Sodio | 0.93 |
| Calcio | 1.00 |
| Hierro | 1.83 |
| Cobre | 1.90 |
| Zinc | 1.65 |
¿Cómo se usa la electronegatividad en la vida cotidiana?
Aunque la electronegatividad es una propiedad esencial en la química, también tiene aplicaciones prácticas en la vida cotidiana. Por ejemplo, las propiedades de los materiales pueden verse afectadas por la electronegatividad.
Por ejemplo, los materiales con alta electronegatividad pueden tener propiedades aislantes, lo que los hace útiles en la fabricación de cables eléctricos y electrónicos. Los materiales con baja electronegatividad, como los metales, pueden ser buenos conductores de electricidad.
Además, la electronegatividad también puede afectar la solubilidad de los compuestos en diferentes solventes. Los compuestos polares, que tienen una alta electronegatividad, son generalmente solubles en solventes polares, como el agua. Los compuestos no polares, que tienen una baja electronegatividad, son solubles en solventes no polares, como los hidrocarburos.
Preguntas frecuentes
¿Cuál es la diferencia entre electronegatividad y afinidad electrónica?
La electronegatividad mide la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. La afinidad electrónica, por otro lado, es la energía liberada cuando un átomo gana un electrón para formar un ion negativo. En otras palabras, la afinidad electrónica mide la capacidad de un átomo para aceptar un electrón adicional.
¿Por qué el flúor tiene la electronegatividad más alta?
El flúor tiene la electronegatividad más alta debido a su tamaño pequeño y su alta carga nuclear efectiva. Los electrones de valencia están muy cerca del núcleo, lo que resulta en una fuerte
Deja una respuesta