Aumenta tu conocimiento: potencial de ionización en la tabla periódica
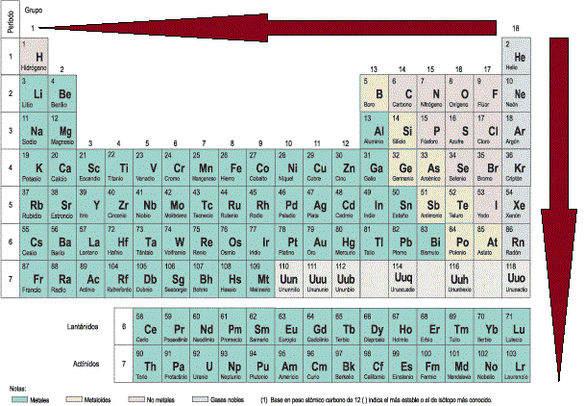
La tabla periódica es una herramienta fundamental en el estudio de la química. A través de ella, podemos conocer las propiedades de los elementos y su comportamiento en distintas situaciones. Una de las propiedades más importantes de los elementos es su potencial de ionización, que nos indica cuánta energía es necesaria para arrancar un electrón de un átomo en estado gaseoso. En este artículo, exploraremos el potencial de ionización en la tabla periódica y su importancia en la química.
¿Qué es el potencial de ionización?
El potencial de ionización es la energía requerida para arrancar un electrón de un átomo en su estado gaseoso y convertirlo en un ion positivo. Cuanto mayor sea el potencial de ionización, más difícil será arrancar un electrón del átomo. El potencial de ionización se mide en electronvoltios (eV) o kilojulios por mol (kJ/mol).
¿Cómo se calcula el potencial de ionización?
El potencial de ionización se calcula midiendo la energía necesaria para arrancar un electrón de un átomo en estado gaseoso. Este proceso puede ser representado por la siguiente ecuación:
X(g) → X+(g) + e-
Donde X representa el átomo y e- el electrón arrancado. La energía necesaria para este proceso puede ser medida experimentalmente y se utiliza para calcular el potencial de ionización.
¿Por qué es importante el potencial de ionización en la química?
El potencial de ionización es una propiedad fundamental de los elementos y es importante en muchos aspectos de la química. Por ejemplo, el potencial de ionización nos indica la reactividad de los elementos. Los elementos con un bajo potencial de ionización tienden a ser más reactivos ya que es más fácil arrancar un electrón y formar un ion. Los elementos con un alto potencial de ionización son menos reactivos ya que es más difícil arrancar un electrón.
Además, el potencial de ionización también es importante en la formación de enlaces químicos. Los elementos con un alto potencial de ionización tienden a formar enlaces iónicos, donde un átomo cede electrones a otro con un bajo potencial de ionización. Por otro lado, los elementos con un bajo potencial de ionización tienden a formar enlaces covalentes, donde los electrones son compartidos entre los átomos.
¿Cómo varía el potencial de ionización en la tabla periódica?
El potencial de ionización varía de manera predecible en la tabla periódica. En general, el potencial de ionización aumenta de izquierda a derecha en un periodo y de abajo hacia arriba en un grupo. Esto se debe a que los electrones en los átomos están más cerca del núcleo en los elementos de la derecha y arriba, lo que hace que sea más difícil arrancarlos.
Por ejemplo, el elemento con el potencial de ionización más bajo es el cesio, que se encuentra en la parte inferior izquierda de la tabla periódica. El elemento con el potencial de ionización más alto es el helio, que se encuentra en la parte superior derecha.
¿Cómo se puede utilizar el potencial de ionización en la vida cotidiana?
El potencial de ionización se utiliza en muchos aspectos de la vida cotidiana. Por ejemplo, en la industria electrónica, el potencial de ionización se utiliza para seleccionar materiales para la fabricación de semiconductores y dispositivos electrónicos. Los materiales con un alto potencial de ionización son útiles para la fabricación de diodos y transistores, mientras que los materiales con un bajo potencial de ionización son útiles para la fabricación de cátodos y emisores de electrones.
Además, el potencial de ionización también se utiliza en la medicina. Por ejemplo, los médicos utilizan la espectroscopia de fotoelectrones de rayos X (XPS) para analizar la composición química de los tejidos y diagnosticar enfermedades. La XPS se basa en la medición del potencial de ionización de los elementos presentes en los tejidos.
Conclusión
El potencial de ionización es una propiedad fundamental de los elementos y es importante en muchos aspectos de la química. Nos indica la reactividad de los elementos, su capacidad para formar enlaces químicos y su comportamiento en diferentes situaciones. Además, el potencial de ionización se utiliza en muchos aspectos de la vida cotidiana, desde la fabricación de dispositivos electrónicos hasta la medicina.
Preguntas frecuentes
1. ¿Por qué el potencial de ionización aumenta de izquierda a derecha en un periodo?
El potencial de ionización aumenta de izquierda a derecha en un periodo porque los electrones en los átomos están más cerca del núcleo en los elementos de la derecha, lo que hace que sea más difícil arrancarlos.
2. ¿Por qué el potencial de ionización aumenta de abajo hacia arriba en un grupo?
El potencial de ionización aumenta de abajo hacia arriba en un grupo porque los electrones en los átomos están más lejos del núcleo en los elementos de arriba, lo que hace que sea más fácil arrancarlos.
3. ¿Cuál es el elemento con el potencial de ionización más bajo?
El elemento con el potencial de ionización más bajo es el cesio, que se encuentra en la parte inferior izquierda de la tabla periódica.
4. ¿Cuál es el elemento con el potencial de ionización más alto?
El elemento con el potencial de ionización más alto es el helio, que se encuentra en la parte superior derecha de la tabla periódica.
5. ¿Cómo se utiliza el potencial de ionización en la medicina?
El potencial de ionización se utiliza en la medicina en la espectroscopia de fotoelectrones de rayos X (XPS) para analizar la composición química de los tejidos y diagnosticar enfermedades. La XPS se basa en la medición del potencial de ionización de los elementos presentes en los tejidos.
Deja una respuesta