La ley de conservación de la masa: ¡todo lo que necesitas saber!
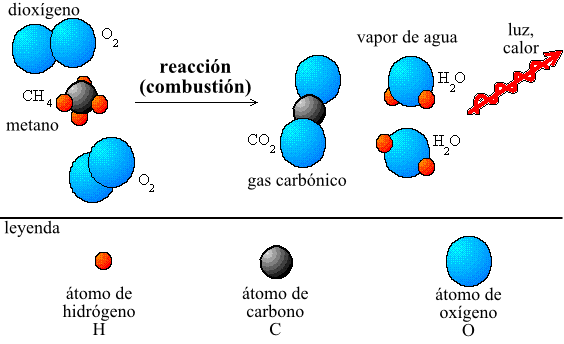
La ley de conservación de la masa, también conocida como la ley de Lavoisier o la ley de conservación de la materia, es una de las leyes fundamentales de la química. Esta ley establece que en cualquier reacción química, la masa total de los reactivos es igual a la masa total de los productos.
En otras palabras, la materia no puede ser creada ni destruida en una reacción química, solo transformada de una forma a otra. Esta ley se aplica a todas las reacciones químicas, desde la combustión de un combustible hasta la descomposición de un compuesto en sus elementos constituyentes.
¿Cómo se descubrió la ley de conservación de la masa?
La ley de conservación de la masa fue descubierta por Antoine Lavoisier, un químico francés del siglo XVIII, quien es considerado el padre de la química moderna. Lavoisier llevó a cabo numerosos experimentos en los que midió cuidadosamente la masa de los reactivos y productos en una variedad de reacciones químicas y siempre encontró que la masa total era la misma.
Uno de los experimentos más famosos de Lavoisier fue la combustión de una vela dentro de un recipiente cerrado. Lavoisier midió la masa total del recipiente antes y después de la combustión de la vela y encontró que la masa total era la misma, lo que demostró la ley de conservación de la masa.
¿Por qué es importante la ley de conservación de la masa?
La ley de conservación de la masa es importante porque nos permite predecir la cantidad de productos que se obtienen en una reacción química en función de la cantidad de reactivos que se utilizan. También nos permite entender cómo se producen las reacciones químicas y cómo se pueden controlar.
Además, la ley de conservación de la masa es fundamental en la resolución de problemas en química y en la industria química, donde es esencial conocer la cantidad de reactivos que se necesitan para producir una cantidad específica de producto.
Ejemplo práctico de la ley de conservación de la masa
Un ejemplo práctico de la ley de conservación de la masa es la reacción química entre el hidrógeno y el oxígeno para producir agua. La ecuación química para esta reacción es:
2H2 + O2 → 2H2O
Esta ecuación indica que se necesitan dos moléculas de hidrógeno y una molécula de oxígeno para producir dos moléculas de agua.
Según la ley de conservación de la masa, la masa total de los reactivos debe ser igual a la masa total de los productos. En este caso, la masa total de los reactivos es:
2(2g) + 1(32g) = 36g
La masa total de los productos es:
2(18g) = 36g
Como se puede ver, la masa total de los reactivos es igual a la masa total de los productos, lo que demuestra la ley de conservación de la masa.
Preguntas frecuentes sobre la ley de conservación de la masa
1. ¿Por qué se llama ley de Lavoisier?
La ley de conservación de la masa se llama a veces ley de Lavoisier en honor a Antoine Lavoisier, quien la descubrió y la demostró experimentalmente.
2. ¿La ley de conservación de la masa se aplica a todas las reacciones químicas?
Sí, la ley de conservación de la masa se aplica a todas las reacciones químicas, desde la combustión de un combustible hasta la descomposición de un compuesto en sus elementos constituyentes.
3. ¿Por qué es importante la ley de conservación de la masa en la industria química?
La ley de conservación de la masa es importante en la industria química porque permite predecir la cantidad de productos que se obtienen en una reacción química en función de la cantidad de reactivos que se utilizan.
4. ¿Cómo se puede demostrar la ley de conservación de la masa experimentalmente?
La ley de conservación de la masa se puede demostrar experimentalmente midiendo la masa total de los reactivos antes de la reacción y la masa total de los productos después de la reacción y comprobando que son iguales.
5. ¿La ley de conservación de la masa se aplica a todas las formas de materia?
Sí, la ley de conservación de la masa se aplica a todas las formas de materia, incluyendo los gases, líquidos y sólidos.
Deja una respuesta