Comparación de estados de agregación: sólido, líquido y gas
Los estados de agregación son las formas en que se presentan los diferentes materiales en la naturaleza. En este artículo, vamos a comparar los tres estados de agregación más comunes: sólido, líquido y gas. A través de esta comparación, podrás entender mejor las diferencias entre ellos y cómo se comportan en diferentes situaciones.
- Estado sólido
- Estado líquido
- Estado gaseoso
- Comparación de los estados de agregación
- Conclusión
-
Preguntas frecuentes
- ¿Todos los materiales pueden existir en los tres estados de agregación?
- ¿Qué sucede cuando un material cambia de estado de agregación?
- ¿Por qué los sólidos son más resistentes que los líquidos y los gases?
- ¿Por qué los líquidos fluyen y los sólidos no?
- ¿Por qué los gases se expanden para llenar cualquier espacio disponible?
Estado sólido
El estado sólido es aquel en el que las partículas que componen el material se encuentran muy juntas y organizadas. Estas partículas se mantienen en una posición fija, lo que hace que el material tenga una forma y un volumen definido. Los sólidos tienen una estructura cristalina que les da una gran resistencia y dureza.
Algunos ejemplos de sólidos son la roca, el hielo y el hierro. A temperatura ambiente, la mayoría de los materiales son sólidos, por lo que es el estado de agregación más común en nuestro entorno.
Estado líquido
El estado líquido es aquel en el que las partículas que componen el material se encuentran cerca unas de otras, pero no tan juntas como en los sólidos. Estas partículas tienen cierta libertad de movimiento, lo que hace que el material no tenga una forma definida, pero sí un volumen definido. Al igual que los sólidos, los líquidos tienen una estructura molecular que les da cierta cohesión.
Algunos ejemplos de líquidos son el agua, la leche y el aceite. Los líquidos son comunes en la naturaleza y en la vida cotidiana, ya que son necesarios para muchas funciones biológicas y procesos industriales.
Estado gaseoso
El estado gaseoso es aquel en el que las partículas que componen el material se encuentran muy separadas y en constante movimiento. Estas partículas tienen total libertad de movimiento, lo que hace que el material no tenga una forma ni un volumen definidos. Los gases no tienen una estructura molecular definida y se expanden para llenar cualquier espacio disponible.
Algunos ejemplos de gases son el oxígeno, el nitrógeno y el dióxido de carbono. Los gases son muy comunes en la atmósfera terrestre y en el universo en general.
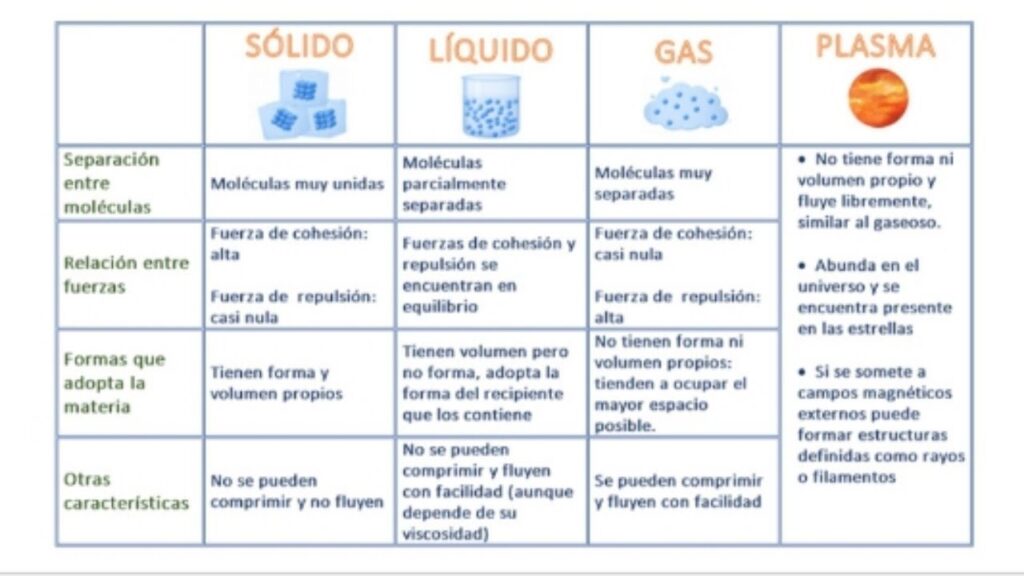
Comparación de los estados de agregación
A continuación, presentamos una tabla que resume las principales diferencias entre los estados de agregación:
| Estado de agregación | Forma | Volumen | Estructura | Movimiento de las partículas | Ejemplos |
|---|---|---|---|---|---|
| Sólido | Definida | Definido | Cristalina | Posición fija | Roca, hielo, hierro |
| Líquido | No definida | Definido | Molecular | Movimiento limitado | Agua, leche, aceite |
| Gas | No definida | No definido | No definida | Movimiento libre | Oxígeno, nitrógeno, dióxido de carbono |
Conclusión
La comparación de los estados de agregación nos permite entender mejor cómo se comportan los materiales en diferentes situaciones. Los sólidos tienen una forma y un volumen definidos, los líquidos tienen un volumen definido pero no una forma definida, y los gases no tienen ni forma ni volumen definidos. Cada estado de agregación tiene sus propias propiedades y características únicas que los hacen importantes en la naturaleza y en la vida cotidiana.
Preguntas frecuentes
¿Todos los materiales pueden existir en los tres estados de agregación?
No todos los materiales pueden existir en los tres estados de agregación. Algunos materiales, como los metales, solo pueden existir en estado sólido o líquido, mientras que otros, como los gases nobles, solo pueden existir en estado gaseoso.
¿Qué sucede cuando un material cambia de estado de agregación?
Cuando un material cambia de estado de agregación, se produce un cambio en las propiedades físicas del material. Por ejemplo, cuando el agua pasa de líquido a gas, se produce una expansión y una disminución de la densidad.
¿Por qué los sólidos son más resistentes que los líquidos y los gases?
Los sólidos son más resistentes que los líquidos y los gases debido a su estructura cristalina. La organización de las partículas en los sólidos les da una mayor cohesión y resistencia.
¿Por qué los líquidos fluyen y los sólidos no?
Los líquidos fluyen porque las partículas que los componen tienen cierta libertad de movimiento. En los sólidos, las partículas están fijas en una posición, lo que les impide fluir.
¿Por qué los gases se expanden para llenar cualquier espacio disponible?
Los gases se expanden para llenar cualquier espacio disponible porque las partículas que los componen tienen total libertad de movimiento. Al no tener una estructura molecular definida, los gases pueden llenar cualquier espacio disponible sin perder su identidad.
Deja una respuesta