Descubre la evolución de los modelos atómicos en una línea del tiempo
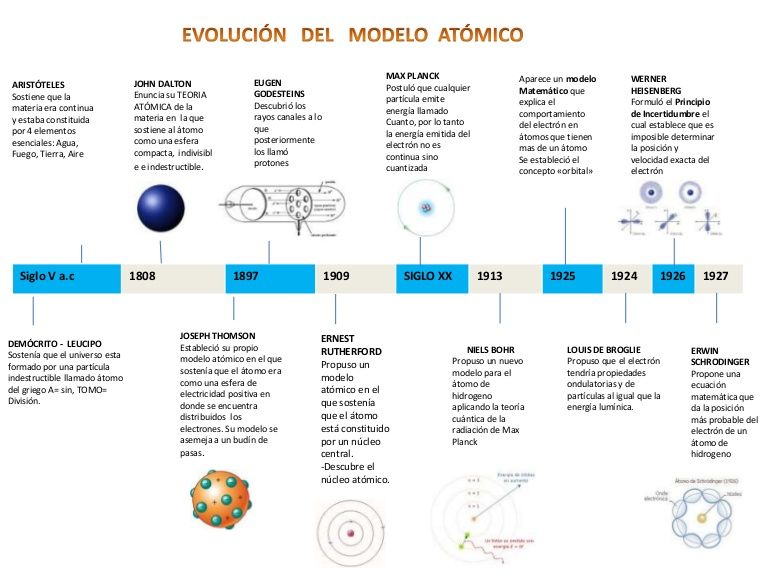
Desde la antigüedad, el ser humano ha tratado de entender la naturaleza de la materia y el mundo que lo rodea. Una de las preguntas más importantes ha sido: ¿de qué están hechas las cosas? La respuesta a esta pregunta ha venido evolucionando a lo largo de la historia, y una de las claves para entenderla es conocer la evolución de los modelos atómicos.
El concepto de átomo, es decir, la idea de que la materia está compuesta por partículas indivisibles, se remonta a la Grecia antigua, donde filósofos como Demócrito y Leucipo postularon la existencia de estas partículas. Sin embargo, no fue hasta el siglo XIX cuando se empezaron a hacer experimentos y se desarrollaron modelos más precisos.
A continuación, presentamos una línea del tiempo con los modelos atómicos más importantes de la historia:
1803 - Modelo de Dalton
El químico británico John Dalton propone que los átomos son esferas sólidas e indivisibles, y que diferentes elementos están compuestos por átomos de diferentes tamaños y pesos.
1897 - Modelo de Thomson
El físico británico J.J. Thomson descubre el electrón, una partícula con carga negativa que orbita alrededor del núcleo del átomo. Propone que los átomos son esferas de carga positiva con electrones incrustados en ellas, como pasas en un pudín.
1911 - Modelo de Rutherford
El físico neozelandés Ernest Rutherford realiza un experimento de dispersión de partículas alfa y descubre que los átomos tienen un núcleo central con carga positiva, rodeado por electrones. Propone que los electrones orbitan alrededor del núcleo como planetas alrededor del sol.
1913 - Modelo de Bohr
El físico danés Niels Bohr propone que los electrones orbitan alrededor del núcleo en niveles discretos de energía, y que los átomos emiten o absorben energía cuando los electrones saltan de un nivel a otro. Este modelo es importante porque explica la estructura de los espectros de emisión y absorción de los elementos.
1926 - Modelo de Schrödinger
El físico austriaco Erwin Schrödinger desarrolla la mecánica cuántica, una teoría que describe la naturaleza de las partículas subatómicas. Propone que los electrones no orbitan alrededor del núcleo como planetas, sino que se comportan como ondas de probabilidad. Su modelo es matemático y se basa en la ecuación de onda de Schrödinger.
1964 - Modelo de Quarks
El físico estadounidense Murray Gell-Mann propone que los protones y los neutrones, las partículas que componen el núcleo del átomo, están hechas de partículas más pequeñas llamadas quarks. Los quarks tienen carga eléctrica fraccionaria y no existen en estado libre, sino que siempre están unidos formando partículas mayores.
Conclusión
La evolución de los modelos atómicos es una muestra de cómo la ciencia avanza a lo largo del tiempo, refinando y mejorando sus teorías a medida que se hacen nuevos descubrimientos y se desarrollan nuevas técnicas experimentales. Cada modelo atómico es una pieza importante del rompecabezas que nos permite entender la naturaleza de la materia y el universo que nos rodea.
Preguntas frecuentes
¿Por qué es importante entender los modelos atómicos?
Los modelos atómicos son la base de la química y la física modernas, y nos permiten entender cómo se comportan los elementos y las partículas subatómicas. Además, son importantes para muchas aplicaciones prácticas, como la tecnología de semiconductores, la energía nuclear y la medicina.
¿Qué es la mecánica cuántica?
La mecánica cuántica es una teoría física que describe el comportamiento de las partículas subatómicas, como los electrones y los quarks. Se basa en el principio de incertidumbre de Heisenberg, que dice que es imposible conocer con precisión la posición y la velocidad de una partícula al mismo tiempo.
¿Por qué los quarks no existen en estado libre?
Los quarks tienen carga eléctrica fraccionaria, lo que significa que no pueden existir en estado libre debido a la fuerza nuclear fuerte, que mantiene unidos los protones y los neutrones en el núcleo del átomo. Los quarks siempre están unidos formando partículas mayores, como protones y neutrones.
¿Qué son los espectros de emisión y absorción?
Los espectros de emisión y absorción son patrones de líneas brillantes o oscuras que se observan cuando se analiza la luz emitida o absorbida por un elemento. Estos patrones son únicos para cada elemento y se utilizan para identificarlos y estudiar su comportamiento.
¿Cómo se relacionan los modelos atómicos con la energía nuclear?
Los modelos atómicos son importantes para entender la estructura del núcleo del átomo y cómo se producen las reacciones nucleares, como la fisión y la fusión. La energía nuclear se basa en la liberación de energía que se produce cuando se altera la estructura del núcleo de un átomo.
Deja una respuesta