Fermiones: imposible tener mismos números cuánticos
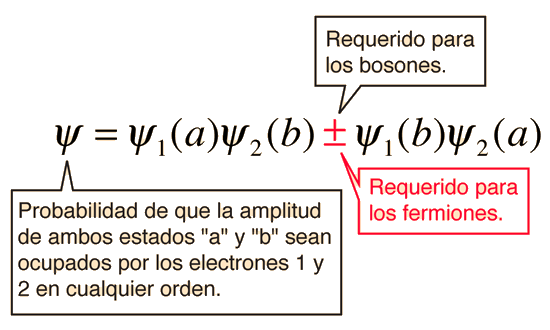
Los fermiones son una categoría de partículas subatómicas que tienen propiedades únicas en el mundo de la física cuántica. A diferencia de los bosones, otra categoría de partículas subatómicas, los fermiones tienen una propiedad conocida como el principio de exclusión de Pauli.
El principio de exclusión de Pauli establece que dos fermiones no pueden ocupar el mismo estado cuántico al mismo tiempo. En otras palabras, no pueden tener los mismos números cuánticos. Esta propiedad tiene implicaciones importantes en la estructura y comportamiento de los átomos y moléculas.
Para entender mejor el principio de exclusión de Pauli, primero debemos entender qué son los números cuánticos. Los números cuánticos son una serie de valores que describen los estados de energía y los movimientos de los electrones en un átomo. Hay cuatro números cuánticos principales: el número cuántico principal, el número cuántico azimutal, el número cuántico magnético y el número cuántico de espín.
El número cuántico principal (n) describe el nivel de energía del electrón en el átomo. El número cuántico azimutal (l) describe el momento angular del electrón en relación con el núcleo del átomo. El número cuántico magnético (m) describe la orientación del momento angular en el espacio. Y el número cuántico de espín (s) describe el giro del electrón sobre su propio eje.
Ahora, volviendo al principio de exclusión de Pauli, este establece que dos fermiones no pueden tener los mismos valores de los cuatro números cuánticos. Esto se debe a que los fermiones tienen una propiedad conocida como espín de media entera, lo que significa que su espín puede ser de 1/2, 3/2, 5/2, etc. Los bosones, por otro lado, tienen un espín entero, lo que significa que su espín puede ser de 0, 1, 2, etc.
Esta propiedad del espín de media entera de los fermiones es lo que hace que sea imposible que dos fermiones tengan los mismos números cuánticos. Si dos fermiones tuvieran los mismos números cuánticos, también tendrían el mismo espín, lo que violaría el principio de exclusión de Pauli.
Esta propiedad del principio de exclusión de Pauli tiene importantes implicaciones en la estructura y comportamiento de los átomos y moléculas. Por ejemplo, el principio de exclusión de Pauli es lo que hace que los electrones en un átomo llenen los niveles de energía en un orden específico y no se acumulen en un solo nivel de energía. También es lo que hace que los átomos y moléculas tengan propiedades químicas únicas y específicas.
Los fermiones son partículas subatómicas que tienen una propiedad única conocida como el principio de exclusión de Pauli. Esta propiedad establece que dos fermiones no pueden ocupar el mismo estado cuántico al mismo tiempo, lo que significa que no pueden tener los mismos números cuánticos. Esta propiedad tiene implicaciones importantes en la estructura y comportamiento de los átomos y moléculas, y es lo que hace que los fermiones sean diferentes de los bosones en el mundo de la física cuántica.
Deja una respuesta