Aprende a preparar solución 0.1N de NaOH fácilmente
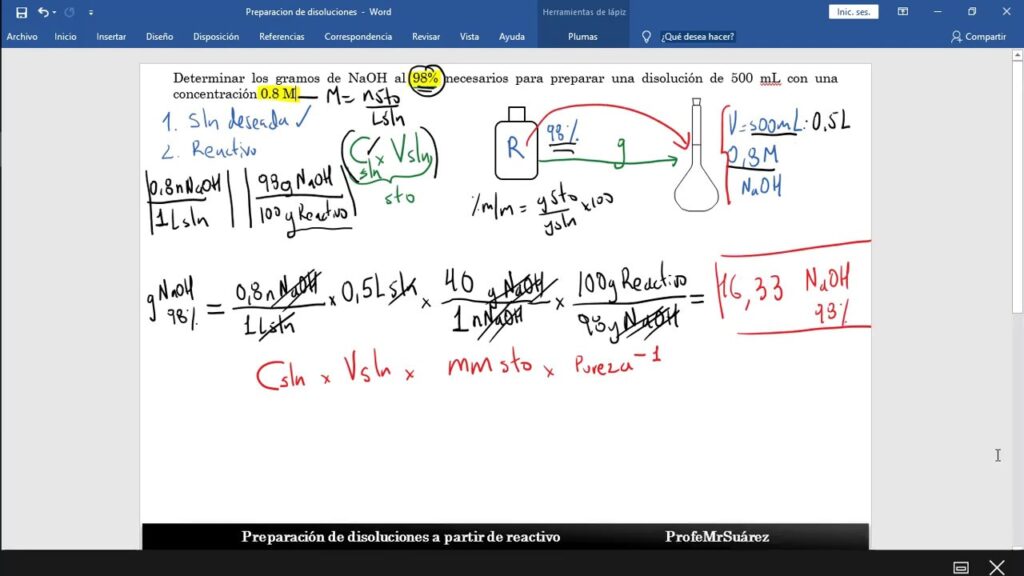
Si eres estudiante de química o trabajas en un laboratorio, es probable que te hayas enfrentado a la tarea de preparar una solución de hidróxido de sodio (NaOH) con una concentración de 0.1N. Aunque puede parecer una tarea complicada, en realidad es bastante sencilla si sigues los pasos correctos. En este artículo, te explicaremos cómo preparar una solución 0.1N de NaOH fácilmente.
- ¿Qué es una solución 0.1N?
- ¿Qué materiales necesitas?
- Pasos para preparar una solución 0.1N de NaOH
- Conclusión
-
Preguntas frecuentes
- 1. ¿Puedo usar agua del grifo en lugar de agua destilada?
- 2. ¿Puedo usar una pipeta graduada en lugar de una pipeta volumétrica?
- 3. ¿Por qué es importante verificar la normalidad de la solución de NaOH?
- 4. ¿Puedo usar una solución de HCl de una normalidad diferente a 0.1N?
- 5. ¿Puedo usar un vaso de precipitados en lugar de un matraz aforado?
¿Qué es una solución 0.1N?
Antes de comenzar, es importante entender qué es una solución 0.1N. La "N" en 0.1N significa "normalidad", que es una medida de la concentración de una solución. Una solución 0.1N de NaOH contiene 0.1 moles de NaOH por litro de solución. En otras palabras, si pesas 4 gramos de NaOH y los disuelves en suficiente agua para hacer un litro de solución, tendrás una solución 0.1N de NaOH.
¿Qué materiales necesitas?
Antes de comenzar, asegúrate de tener los siguientes materiales:
- NaOH sólido
- Agua destilada
- Una balanza
- Una pipeta volumétrica
- Un matraz aforado de 1 litro
- Una varilla de agitación
- Guantes de protección y gafas de seguridad
Pasos para preparar una solución 0.1N de NaOH
Una vez que tengas todos los materiales necesarios, sigue estos pasos para preparar una solución 0.1N de NaOH:
Paso 1: Pesado del NaOH sólido
Pesa 4 gramos de NaOH sólido en una balanza. Usa guantes de protección para manipular el NaOH.
Paso 2: Disolución del NaOH en agua destilada
Añade el NaOH al matraz aforado de 1 litro y agrega agua destilada hasta la marca de 1 litro. Agita suavemente para asegurarte de que el NaOH se disuelve completamente en el agua.
Paso 3: Mezcla la solución
Usa una varilla de agitación para mezclar la solución. Asegúrate de que esté completamente mezclada antes de continuar.
Paso 4: Verificación de la normalidad
Usa una pipeta volumétrica para medir 20 ml de la solución y colócala en un matraz. Agrega 2-3 gotas de fenolftaleína al matraz. La solución cambiará de incolora a rosa claro. Luego, titula la solución con una solución de ácido clorhídrico (HCl) 0.1N hasta que el color rosa desaparezca. Toma nota de la cantidad de HCl que se ha utilizado.
Paso 5: Cálculo de la normalidad
Usa la fórmula N1V1 = N2V2 para calcular la normalidad de la solución de NaOH. En esta fórmula, N1 es la normalidad de la solución de ácido utilizado (0.1N), V1 es la cantidad de ácido utilizado en ml, N2 es la normalidad de la solución de NaOH que estás preparando (que es lo que quieres calcular) y V2 es el volumen de la solución de NaOH que utilizaste para la titulación. Si usaste 20 ml de solución de NaOH para la titulación, V2 es 20 ml.
Paso 6: Ajuste de la normalidad
Si la normalidad de la solución de NaOH que has preparado no es 0.1N, ajusta la solución agregando más agua destilada o más NaOH sólido según sea necesario. Repite los pasos 4 y 5 hasta que tengas una solución de NaOH con una normalidad de 0.1N.
Conclusión
Preparar una solución 0.1N de NaOH es una tarea sencilla si sigues los pasos correctos. Recuerda usar guantes de protección y gafas de seguridad y asegúrate de tener los materiales necesarios. Si sigues estos pasos, tendrás una solución de NaOH con una concentración de 0.1N lista para usar en tus experimentos de química.
Preguntas frecuentes
1. ¿Puedo usar agua del grifo en lugar de agua destilada?
No se recomienda usar agua del grifo para preparar soluciones químicas porque puede contener impurezas que alteren la concentración de la solución.
2. ¿Puedo usar una pipeta graduada en lugar de una pipeta volumétrica?
No se recomienda usar una pipeta graduada porque no es tan precisa como una pipeta volumétrica. Si no tienes una pipeta volumétrica, puedes comprar una o pedir prestada una de un compañero de laboratorio.
3. ¿Por qué es importante verificar la normalidad de la solución de NaOH?
Es importante verificar la normalidad de la solución de NaOH para asegurarse de que la solución tiene la concentración correcta para su uso en experimentos de química. Si la solución no tiene la concentración correcta, los resultados de los experimentos pueden ser inexactos.
4. ¿Puedo usar una solución de HCl de una normalidad diferente a 0.1N?
En teoría, puedes usar una solución de HCl de cualquier normalidad para titular la solución de NaOH. Sin embargo, si usas una solución de HCl de una normalidad diferente a 0.1N, tendrás que ajustar la fórmula de cálculo de normalidad en el paso 5.
5. ¿Puedo usar un vaso de precipitados en lugar de un matraz aforado?
No se recomienda usar un vaso de precipitados en lugar de un matraz aforado porque los vasos de precipitados no tienen una marca de volumen precisa y pueden tener una forma que hace que sea difícil medir volúmenes precisos.
Deja una respuesta